Micellen zijn microscopisch kleine clusters van moleculen met een bolvormige structuur. Ze vormen een veelgebruikte en zeer effectieve groep oppervlakteactieve stoffen, oftewel surfactanten. Dankzij hun unieke eigenschappen spelen ze een zeer belangrijke rol in veel industrieën, waaronder de cosmetica.

Door hun structuur absorberen micellen vrijwel alle soorten onzuiverheden van het oppervlak waarop ze worden aangebracht. Micellen worden het vaakst genoemd in de context van gezichtsreinigende cosmetica, maar ze zijn ook ingrediënten in producten zoals wasmiddelen en afwasmiddelen. Micellaire oplossingen worden gekenmerkt door hun vermogen om slecht oplosbare verbindingen op te lossen, wat de definitie is van het solubilisatieproces.
Structuur en eigenschappen van micellen
De structuur van micellen bepaalt hun unieke fysicochemische eigenschappen. In deze sectie bekijken we hoe micellen ontstaan, waaruit ze bestaan en welke processen hun gedrag in oplossingen bepalen.
Door de ogen van een chemicus
Micellen zijn niets meer dan associatieve colloïden die gevormd worden als resultaat van het micellisatieproces . Dit proces verwijst naar de transformatie van amfifiele moleculen of ionen, die, als gevolg van oplossen, zelfassociatie ondergaan tot grotere clusters. Micellen zijn daarom geen specifieke groep chemische verbindingen, maar eerder een specifieke organisatievorm van hun moleculen. Deze spontane transformatie, resulterend in de vorming van micellen, is kenmerkend voor verschillende organische stoffen waarvan de moleculen uit twee delen met significant verschillende polariteiten bestaan. Wanneer het gehalte aan oppervlakteactieve stoffen in een oplossing toeneemt, beginnen deze karakteristieke structuren zich te vormen bij een bepaalde concentratie van associaties. Het startpunt voor dergelijke transformaties wordt de CMC-concentratie genoemd.
Waar staat CMC voor?
CMC, of kritische micellisatieconcentratie , is de concentratie waarbij micellen zich beginnen te vormen als gevolg van de zelf-omzetting van geaccumuleerde monomeren in grotere aggregaten . Deze vorming van clusters van moleculen gaat ook gepaard met een verandering in hun fysische eigenschappen.
Boven de CMC blijft zo’n groep moleculen in evenwicht met individuele moleculen, waardoor ze een thermodynamisch stabiele vorm worden. Dit evenwicht is een belangrijk overgangspunt, omdat het continu in beide richtingen kan verlopen. Tijdens verdunning vallen de micellen bijvoorbeeld weer uiteen. Beneden de CNC-concentratie bewegen de oppervlakteactieve moleculen vrij in de oplossing zonder enige georganiseerde structuur.
Fysische eigenschappen van micellen
Naarmate de concentratie van de oppervlakteactieve stof in de oplossing toeneemt, vinden de volgende veranderingen plaats:
- Oppervlaktespanning,
- Elektrische geleidbaarheid,
- Lichtverstrooiingsintensiteit,
- Viscositeit.
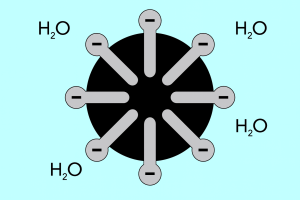
Hoofd en staart – structuur van micellen
De structuur van micellen kan worden onderverdeeld in twee hoofddelen, die aanzienlijk verschillen in polariteit en die worden genoemd:
- Hydrofiele kop , die een hoge affiniteit voor water heeft. Het is het deel van de micel dat verantwoordelijk is voor de neiging van deeltjes om zich met water te binden, maar ook voor het afstoten van vetten.
- De hydrofobe staart , ook wel lipofiele staart genoemd, heeft het tegenovergestelde effect: hij trekt moleculen aan naar vetten en stoot water af.
Het hydrofobe gebied bestaat meestal uit koolwaterstofketens, radicalen:
- alkyl,
- alkylaryl,
- gefluoreerde koolwaterstofradicalen.
Het hydrofiele gebied bestaat uit groepen die sterk genoeg met water interacteren, zoals ionogene groepen. Niet-ionogene groepen, zoals ethergroepen, kunnen ook deel uitmaken van het hydrofiele gebied van micellen, maar hiervoor is meestal de aanwezigheid van een groter aantal polaire groepen in het molecuul vereist.
Het micellisatieproces
Doordat het apolaire deel van de stof, bijvoorbeeld de alkylketen van een enkel gedispergeerd oppervlakteactieve stofmolecuul, een groot contactoppervlak met water heeft, en de interactie tussen meerdere watermoleculen veel sterker is dan hun interactie met de –CH 2 -groepen die in de keten aanwezig zijn, neemt de entropie van het systeem af en beginnen de watermoleculen zich te organiseren ter hoogte van de alkylketen.
Dit veroorzaakt een soort verdringing van koolwaterstofketens uit het binnenste van de waterige fase. Naarmate de concentratie van de oppervlakteactieve stof toeneemt, neemt ook het aantal botsingen tussen hen toe. Dit vergroot ook de kans op aggregatie en verdikking van de moleculen.
De condensatie van moleculen gaat gepaard met een afname van de vrije enthalpie. Dit is ook het resultaat van de combinatie van apolaire residuen met een apolaire kern in vloeibare toestand, die door polaire groepen van de waterige fase wordt gescheiden.
Zodra de bovengenoemde CMC-concentratie, d.w.z. de kritische micelconcentratie, is bereikt, vormen zich bolvormige clusters, waarin de polaire groepen van individuele deeltjes naar de waterige fase worden geleid, terwijl de apolaire koolwaterstofketens het binnenste vormen. De micellen die op deze manier worden gevormd, worden normale micellen genoemd.
In organische oplosmiddelen kunnen omgekeerde micellen ontstaan, waarbij het hydrofobe deel zich aan de buitenkant bevindt.

Soorten en voorbeelden van oppervlakteactieve stoffen
Het type oppervlakteactieve stof dat wordt gebruikt om micellen te vormen, heeft een enorme impact op hun structuur en functionaliteit. Hieronder vindt u de meest voorkomende soorten en voorbeelden van oppervlakteactieve stoffen die micellen vormen.
Voorbeelden van oppervlakte-actieve ionen
Negatief geladen ionen, kationen:
- carboxylaat,
- sulfaat,
- sulfonaat,
- fosfaat.
Positief geladen ionen, kationen:
- ammonium,
- fosfonium.
Soorten oppervlakteactieve stoffen
- Ionische oppervlakteactieve stoffen
- Anionisch, bijvoorbeeld SDS of natriumdodecylsulfaat,
- Kationisch, bijvoorbeeld CTAB of cetyltrimethylammoniumbromide,
- Amfionen, d.w.z. ionen die amfifiel of bipolair worden genoemd, die zowel een positief geladen kationische groep als een negatief geladen anionische groep hebben, bijvoorbeeld lecithine of fosfatidyloline.
- Niet-ionogene oppervlakteactieve stoffen, bijvoorbeeld polyoxyethylenen.
Oppervlakteactiviteit van oppervlakteactieve stoffen en micelstructuur
Deze parameter, kenmerkend voor oppervlakteactieve verbindingen, neemt toe met het aantal methyleengroepen dat in de koolwaterstofketen aanwezig is.
Vanwege de structuur van de keten kunnen micellen worden onderverdeeld in:
- Enkelvoudige ketting
- Anionisch, bijvoorbeeld SDS,
- Kationisch, bijv. CTAB.
- Dubbele keten
- Anionisch, bijvoorbeeld AOT, d.w.z. natriumbis(2-ethylhexyl)succinaatsulfonaat,
- Kationisch, bijv. dihexadecyldimethylammoniumbromide.
- Moleculair, bijvoorbeeld MGDG, d.w.z. monogalactosyldiglyceride.

Toepassing van micellen
Micellen hebben een breed scala aan toepassingen, van cosmetica tot farmaceutica en de chemische industrie. Lees meer over de belangrijkste gebieden waar hun eigenschappen in de praktijk worden gebruikt.
Effectieve huidreiniging
Dit is mogelijk dankzij de aanwezigheid van zowel lipofiele als hydrofiele deeltjes. Zo binden hydrofobe deeltjes in make-upremovers met micellair water zich aan talg en make-upresten op de huid, terwijl hydrofiele deeltjes stof en vuil aantrekken. Dit resulteert in een dubbel reinigend effect, waardoor een effectieve en grondige reiniging mogelijk is zonder onnodige uitdroging of irritatie. Micellaire producten worden zelfs aanbevolen voor de gevoelige huid vanwege hun milde werking. Het is niet nodig om te schrobben of hard te drukken met wattenschijfjes, en de werking van deze colloïden is te vergelijken met die van een magneet op vuil. Waterige oplossingen met micellen verstoren de hydrolipidenlaag van de opperhuid niet.
Formulering van micellaire cosmetica
Een ander voordeel van micellen, die zeer kleine deeltjes zijn, is dat er geen beperkingen zijn aan de formuleringen waarin ze gebruikt kunnen worden. Ze kunnen gebruikt worden in hun meest populaire vorm – micellair water – maar ook in crèmes en lotions.
Er zijn ook sterk geconcentreerde gelformules verkrijgbaar, die geen handdoeken of wattenschijfjes nodig hebben, maar alleen in de huid gemasseerd en afgespoeld hoeven te worden met water.
Drie-fase werking van micellen
- Aantrekken van onzuiverheden dankzij hydrofobe staarten,
- Inkapseling , waarbij vet- en vuilmoleculen in de micellen worden gevangen,
- Verwijdering van onzuiverheden die in micellen gevangen zitten, via hydrofiele koppen die in contact blijven met de waterige fase.
Andere industriële toepassingen van micellen
- Cosmetica , voornamelijk micellaire vloeistoffen en make-up remover lotions, maar ook micellaire shampoos voor een diepe reiniging van de hoofdhuid en douchegels.
- Farmacie , bijvoorbeeld om de biologische beschikbaarheid van werkzame stoffen te vergroten door geneesmiddelen met een beperkte oplosbaarheid in de vorm van niet-ionische micellaire oplossingen in het lichaam te brengen.
- Reinigingsproducten – het eerder genoemde solubilisatieproces verklaart de fysicochemie van het wassen. Micellaire colloïden in de vorm van oplossingen omringen vet, scheiden vuil af en verwijderen het van de stof. Bij gebruik van ionische oppervlakteactieve stoffen krijgen de vuildeeltjes en het oppervlak waaraan ze hechten dezelfde lading, waardoor ze gemakkelijk van elkaar te scheiden zijn.
- Fysische en chemische processen : micellaire katalyse, remming van chemische reacties, flotatie en oliewinningsprocessen.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf



























































































































