Misel ialah gugusan molekul mikroskopik yang dicirikan oleh struktur sfera. Ia adalah kumpulan sebatian aktif permukaan yang biasa digunakan dan sangat berkesan, iaitu surfaktan. Terima kasih kepada sifat uniknya, ia memainkan peranan yang sangat penting dalam banyak industri, termasuk kosmetologi.

Disebabkan strukturnya, misel secara praktikal menyerap semua jenis kekotoran dari permukaan yang digunakan. Micelles paling kerap disebut dalam konteks kosmetik pencuci muka, tetapi ia juga merupakan bahan dalam produk seperti detergen dobi dan cecair pencuci pinggan. Larutan misel dicirikan oleh keupayaannya untuk melarutkan sebatian yang tidak larut, yang merupakan definisi proses pelarutan.
Struktur dan sifat misel
Struktur misel menentukan sifat fizikokimia yang unik. Dalam bahagian ini, kita akan melihat bagaimana misel terbentuk, komposisinya dan proses apakah yang menentukan tingkah lakunya dalam penyelesaian.
Melalui mata seorang ahli kimia
Misel tidak lebih daripada koloid bersekutu yang terbentuk hasil daripada proses miselisasi . Proses ini merujuk kepada transformasi molekul atau ion amphiphilic, yang, sebagai hasil daripada pembubaran, mengalami perkaitan diri kepada kelompok yang lebih besar.
Misel oleh itu bukanlah kumpulan sebatian kimia tertentu, sebaliknya merupakan bentuk organisasi khusus molekulnya. Transformasi spontan yang mengakibatkan pembentukan misel ini adalah ciri pelbagai bahan organik yang molekulnya terdiri daripada dua bahagian dengan kekutuban yang berbeza secara ketara.
Apabila kandungan surfaktan dalam larutan meningkat, pada kepekatan tertentu bersekutu, struktur ciri ini mula terbentuk. Titik permulaan untuk transformasi sedemikian dipanggil kepekatan CMC.
Apakah maksud CMC?
CMC, atau kepekatan miselisasi kritikal , ialah kepekatan di mana misel mula terbentuk akibat daripada monomer terkumpul sendiri kepada agregat yang lebih besar . Pembentukan kelompok molekul ini juga disertai dengan perubahan dalam sifat fizikalnya.
Di atas CMC, kumpulan molekul sedemikian kekal dalam keseimbangan dengan molekul individu, dengan itu menjadi bentuk yang stabil secara termodinamik. Keseimbangan ini merupakan titik utama peralihan, kerana ia boleh diteruskan secara berterusan dalam kedua-dua arah. Sebagai contoh, semasa pencairan, misel rosak semula. Di bawah kepekatan CNC, molekul surfaktan bergerak bebas dalam larutan tanpa sebarang struktur tersusun.
Sifat fizikal misel
Apabila kepekatan surfaktan dalam larutan meningkat, perubahan berikut berlaku:
- Ketegangan permukaan,
- Kekonduksian elektrik,
- Keamatan serakan cahaya,
- Kelikatan.
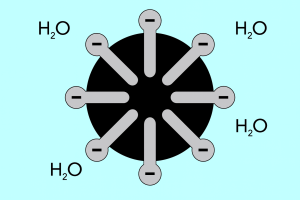
Kepala dan ekor – struktur misel
Struktur misel boleh dibahagikan kepada dua bahagian utama, yang berbeza secara ketara dalam kekutuban dan dipanggil:
- Kepala hidrofilik , yang mempunyai pertalian tinggi terhadap air. Ia adalah bahagian misel yang bertanggungjawab terhadap kecenderungan zarah untuk bergabung dengan air, tetapi juga untuk menangkis lemak.
- Ekor hidrofobik , juga dikenali sebagai ekor lipofilik, yang mempunyai kesan sebaliknya – ia menarik molekul ke lemak dan menolak air.
Kawasan hidrofobik selalunya adalah rantai hidrokarbon, radikal:
- alkil,
- alkylaryl,
- radikal hidrokarbon terfluorinasi.
Kawasan hidrofilik terdiri daripada kumpulan yang berinteraksi cukup kuat dengan air, seperti kumpulan ionogenik. Kumpulan bukan ionik, seperti kumpulan eter, juga boleh membentuk sebahagian daripada kawasan hidrofilik misel, tetapi ini biasanya memerlukan kehadiran lebih banyak kumpulan polar dalam molekul.
Proses miselisasi
Disebabkan fakta bahawa bahagian bukan kutub bahan, contohnya rantai alkil bagi molekul surfaktan terdispersi tunggal, mempunyai luas permukaan yang besar bersentuhan dengan air, dan interaksi antara beberapa molekul air adalah jauh lebih kuat daripada interaksinya dengan kumpulan –CH 2 yang terdapat dalam rantai, entropi sistem berkurangan dan molekul air pada jenis rantai mula tersusun dengan sendiri
anjakan rantai hidrokarbon dari bahagian dalam fasa akueus. Apabila kepekatan surfaktan bertambah, begitu juga bilangan perlanggaran antara mereka. Ini juga meningkatkan kemungkinan pengagregatan dan penebalan molekul.
Pemeluwapan molekul disertai dengan penurunan entalpi bebas. Ini juga adalah hasil daripada gabungan sisa bukan kutub dengan teras bukan kutub dalam keadaan cecair, yang dipisahkan daripada fasa akueus oleh kumpulan kutub.
Sebaik sahaja kepekatan CMC yang disebutkan di atas, iaitu kepekatan misel kritikal, dicapai, gugusan sfera terkumpul, di mana kumpulan kutub zarah-zarah individu dihalakan ke arah fasa-zarah bukan karbon. Misel yang terbentuk dengan cara ini dipanggil misel biasa.
Dalam pelarut organik, misel terbalik mungkin berlaku, di mana bahagian hidrofobik terletak di bahagian luar.

Jenis dan contoh surfaktan
Jenis surfaktan yang digunakan untuk membentuk misel mempunyai kesan yang besar terhadap struktur dan fungsinya. Di bawah anda akan menemui jenis dan contoh surfaktan yang paling biasa yang membentuk misel
Contoh ion aktif permukaan
Ion bercas negatif, kation:
- karboksilat,
- sulfat,
- sulfonat,
- fosfat.
Ion bercas positif, kation:
- ammonium,
- fosfonium.
Jenis surfaktan
- Surfaktan ionik
- Anionik, contohnya SDS, atau Sodium dodecylsulfate,
- Kationik, contohnya CTAB, atau setil trimetil ammonium bromida,
- Amfion, iaitu ion yang dipanggil amphiphilic atau bipolar, yang mempunyai kedua-dua kumpulan kationik bercas positif dan kumpulan anionik bercas negatif, cth Lecithin, iaitu Phosphatidyloline.
- Surfaktan bukan ionik, contohnya Polioksietilena.
Aktiviti permukaan surfaktan dan struktur misel
Parameter ini, ciri sebatian aktif permukaan, meningkat dengan bilangan kumpulan metilena yang terdapat dalam rantai hidrokarbon.
Disebabkan oleh struktur rantai, misel boleh dibahagikan kepada:
- Rantai tunggal
- Anionik, cth SDS,
- Kationik, cth CTAB.
- Rantai dua
- Anionik, cth AOT, iaitu natrium bis(2-etilheksil) suksinatsulfonat,
- Kationik, cth dihexadecyldimethylammonium bromide.
- Molekul, cth MGDG, iaitu monogalactosil diglyceride.

Penggunaan misel
Misel mempunyai pelbagai aplikasi, daripada kosmetologi kepada farmaseutikal dan industri kimia. Ketahui tentang kawasan paling penting di mana sifatnya digunakan dalam amalan.
Pembersihan kulit yang berkesan
Ini mungkin berlaku kerana kehadiran kedua-dua zarah lipofilik dan hidrofilik. Contohnya, dalam penanggal solekan yang mengandungi air micellar, zarah hidrofobik mengikat sebum dan sisa solekan pada kulit, manakala zarah hidrofilik menarik habuk dan kotoran. Ini menghasilkan kesan pembersihan dwi, membolehkan pembersihan yang berkesan dan menyeluruh tanpa pengeringan atau kerengsaan yang tidak perlu.
Produk micellar malah disyorkan untuk jenis kulit sensitif kerana tindakannya yang lembut. Tidak perlu menggosok atau menekan kuat dengan pad kapas, dan tindakan koloid ini dibandingkan dengan magnet pada kotoran. Larutan akueus dengan misel tidak mengganggu lapisan hidrolipid epidermis.
Formulasi kosmetik micellar
Satu lagi kelebihan micelles, yang merupakan zarah yang sangat kecil, ialah tiada sekatan pada formulasi di mana ia boleh digunakan. Ia boleh digunakan dalam bentuk yang paling popular – air micellar – tetapi juga dalam krim dan losyen.
Formula gel yang sangat pekat juga tersedia, yang tidak memerlukan penggunaan tuala atau pad kapas, tetapi hanya perlu diurut ke dalam kulit dan dibilas dengan air.
Tindakan tiga peringkat misel
- Menarik kekotoran terima kasih kepada ekor hidrofobik,
- Enkapsulasi , yang memerangkap molekul lemak dan kotoran di dalam misel,
- Penyingkiran bendasing yang terperangkap dalam misel melalui kepala hidrofilik yang masih bersentuhan dengan fasa akueus.
Aplikasi perindustrian lain micelles
- Kosmetologi , terutamanya cecair micellar dan losyen penanggal solekan, tetapi juga syampu micellar untuk pembersihan kulit kepala dan gel mandian secara mendalam.
- Farmasi , contohnya untuk meningkatkan bioavailabiliti bahan aktif dengan memperkenalkan ubat dengan keterlarutan terhad ke dalam badan dalam bentuk larutan misel bukan ionik.
- Produk pembersihan – proses pelarutan yang disebutkan di atas menerangkan fizikokimia pencucian. Koloid misel dalam bentuk larutan mengelilingi lemak, mengasingkan kotoran dan mengeluarkannya dari kain. Apabila surfaktan ionik digunakan, zarah-zarah kotoran dan permukaan yang melekat padanya memperoleh cas yang sama, menjadikannya mudah untuk dipisahkan antara satu sama lain.
- Proses fizikal dan kimia : pemangkinan micellar, perencatan tindak balas kimia, pengapungan dan proses pemulihan minyak.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf






























































































































