Micely sú mikroskopické zhluky molekúl charakterizované guľovitou štruktúrou. Sú bežne používanou a veľmi účinnou skupinou povrchovo aktívnych zlúčenín, teda povrchovo aktívnych látok. Vďaka svojim jedinečným vlastnostiam zohrávajú veľmi dôležitú úlohu v mnohých odvetviach vrátane kozmetológie.

Vďaka svojej štruktúre micely absorbujú prakticky všetky druhy nečistôt z povrchu, na ktorý sa nanášajú. Micely sa najčastejšie spomínajú v kontexte kozmetiky na čistenie tváre, ale sú aj zložkami produktov, ako sú pracie prostriedky a prostriedky na umývanie riadu. Micelárne roztoky sa vyznačujú schopnosťou rozpúšťať ťažko rozpustné zlúčeniny, čo je definícia procesu solubilizácie.
Štruktúra a vlastnosti micel
Štruktúra micel určuje ich jedinečné fyzikálno-chemické vlastnosti. V tejto časti sa pozrieme na to, ako micely vznikajú, z čoho sú zložené a aké procesy určujú ich správanie v roztokoch.
Očami chemika
Micely nie sú ničím iným ako asociatívnymi koloidmi, ktoré vznikajú v dôsledku procesu micelizácie . Tento proces sa vzťahuje na transformáciu amfifilných molekúl alebo iónov, ktoré v dôsledku rozpúšťania podliehajú samozdružovaniu do väčších zhlukov.
Micely teda nie sú špecifickou skupinou chemických zlúčenín, ale skôr špecifickou formou organizácie ich molekúl. Táto spontánna transformácia, ktorá vedie k tvorbe micel, je charakteristická pre rôzne organické látky, ktorých molekuly sa skladajú z dvoch častí s výrazne odlišnou polaritou.
Keď sa obsah povrchovo aktívnych látok v roztoku zvýši, pri určitej koncentrácii asociátov sa začnú tvoriť tieto charakteristické štruktúry. Východiskový bod pre takéto transformácie sa nazýva koncentrácia CMC.
Čo znamená skratka CMC?
CMC alebo kritická koncentrácia micelizácie je koncentrácia, pri ktorej sa micely začínajú tvoriť v dôsledku samovoľného rozpadu nahromadených monomérov do väčších agregátov . Túto tvorbu zhlukov molekúl sprevádza aj zmena ich fyzikálnych vlastností.
Nad CMC zostáva takáto skupina molekúl v rovnováhe s jednotlivými molekulami, čím sa stáva termodynamicky stabilnou formou. Táto rovnováha je kľúčovým bodom prechodu, pretože môže prebiehať kontinuálne v oboch smeroch. Napríklad počas riedenia sa micely opäť rozpadajú. Pod koncentráciou CNC sa molekuly povrchovo aktívnej látky voľne pohybujú v roztoku bez akejkoľvek organizovanej štruktúry.
Fyzikálne vlastnosti micel
So zvyšujúcou sa koncentráciou povrchovo aktívnej látky v roztoku dochádza k nasledujúcim zmenám:
- Povrchové napätie,
- Elektrická vodivosť,
- Intenzita rozptylu svetla,
- Viskozita.
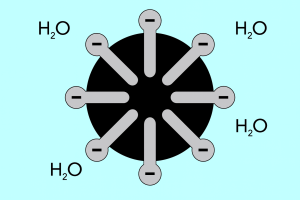
Hlava a chvost – štruktúra micel
Štruktúru micel možno rozdeliť na dve hlavné časti, ktoré sa výrazne líšia polaritou a nazývajú sa:
- Hydrofilná hlava , ktorá má vysokú afinitu k vode. Je to časť micely, ktorá je zodpovedná za tendenciu častíc spájať sa s vodou, ale aj za odpudzovanie tukov.
- Hydrofóbny chvost , tiež známy ako lipofilný chvost, má opačný účinok – priťahuje molekuly k tukom a odpudzuje vodu.
Hydrofóbna oblasť je najčastejšie tvorená uhľovodíkovými reťazcami, radikálmi:
- alkyl,
- alkylaryl,
- fluórované uhľovodíkové radikály.
Hydrofilná oblasť pozostáva zo skupín, ktoré dostatočne silno interagujú s vodou, ako sú napríklad ionogénne skupiny. Neiónové skupiny, ako sú napríklad éterové skupiny, môžu tiež tvoriť súčasť hydrofilnej oblasti micel, ale to zvyčajne vyžaduje prítomnosť väčšieho počtu polárnych skupín v molekule.
Proces micelizácie
Vzhľadom na to, že nepolárna časť látky, napríklad alkylový reťazec jednej dispergovanej molekuly povrchovo aktívnej látky, má veľký povrch v kontakte s vodou a interakcia medzi niekoľkými molekulami vody je oveľa silnejšia ako ich interakcia so skupinami –CH2 prítomnými v reťazci, entropia systému sa znižuje a molekuly vody sa začínajú organizovať na mieste alkylového reťazca.
To spôsobuje určitý druh vytesňovania uhľovodíkových reťazcov z vnútra vodnej fázy. So zvyšujúcou sa koncentráciou povrchovo aktívnej látky sa zvyšuje aj počet zrážok medzi nimi. To tiež zvyšuje pravdepodobnosť agregácie a zhrubnutia molekúl.
Kondenzácia molekúl je sprevádzaná poklesom voľnej entalpie. Toto je tiež výsledok kombinácie nepolárnych zvyškov s nepolárnym jadrom v kvapalnom stave, ktoré je od vodnej fázy oddelené polárnymi skupinami.
Po dosiahnutí spomínanej koncentrácie CMC, teda kritickej koncentrácie micel, sa hromadia sférické zhluky, v ktorých sú polárne skupiny jednotlivých častíc smerované do vodnej fázy, zatiaľ čo nepolárne uhľovodíkové reťazce tvoria vnútro. Takto vytvorené micely sa nazývajú normálne micely.
V organických rozpúšťadlách sa môžu vyskytovať reverzné micely, v ktorých sa hydrofóbna časť nachádza na vonkajšej strane.

Typy a príklady povrchovo aktívnych látok
Typ povrchovo aktívnych látok používaných na tvorbu micel má obrovský vplyv na ich štruktúru a funkčnosť. Nižšie nájdete najbežnejšie typy a príklady povrchovo aktívnych látok, ktoré tvoria micely
Príklady povrchovo aktívnych iónov
Záporne nabité ióny, katióny:
- karboxylát,
- síran,
- sulfonát,
- fosfát.
Kladne nabité ióny, katióny:
- amónny,
- fosfónium.
Typy povrchovo aktívnych látok
- Iónové povrchovo aktívne látky
- Aniónové, napríklad SDS alebo dodecylsulfát sodný,
- Katiónové, napríklad CTAB alebo cetyltrimetylamóniumbromid,
- Amfióny, teda ióny nazývané amfifilné alebo bipolárne, ktoré majú kladne nabitú katiónovú skupinu aj záporne nabitú aniónovú skupinu, napr. lecitín, teda fosfatidylolín.
- Neiónové povrchovo aktívne látky, napríklad polyoxyetylény.
Povrchová aktivita povrchovo aktívnych látok a micelárna štruktúra
Tento parameter, charakteristický pre povrchovo aktívne zlúčeniny, sa zvyšuje s počtom metylénových skupín prítomných v uhľovodíkovom reťazci.
Vzhľadom na štruktúru reťazca možno micely rozdeliť na:
- Jednoreťazcový
- Aniónové, napr. SDS,
- Katiónové, napr. CTAB.
- Dvojitý reťazec
- Aniónové, napr. AOT, t. j. bis(2-etylhexyl)sukcinátsulfonát sodný,
- Katiónové, napr. dihexadecyldimetylamóniumbromid.
- Molekulárny, napr. MGDG, t. j. monogalaktozyldiglycerid.

Aplikácia micel
Micely majú široké uplatnenie, od kozmetológie až po farmaceutický a chemický priemysel. Zistite viac o najdôležitejších oblastiach, kde sa ich vlastnosti využívajú v praxi.
Účinné čistenie pleti
Toto je možné vďaka prítomnosti lipofilných aj hydrofilných častíc. Napríklad v odličovačoch obsahujúcich micelárnu vodu sa hydrofóbne častice viažu na maz a zvyšky mejkapu na pokožke, zatiaľ čo hydrofilné častice priťahujú prach a nečistoty. Výsledkom je dvojitý čistiaci účinok, ktorý umožňuje účinné a dôkladné čistenie bez zbytočného vysušovania alebo podráždenia.
Micelárne produkty sa vďaka svojmu šetrnému pôsobeniu odporúčajú aj pre citlivú pleť. Nie je potrebné ich drhnúť ani silno tlačiť vatovými tampónmi a pôsobenie týchto koloidov sa prirovnáva k pôsobeniu magnetu na nečistoty. Vodné roztoky s micelami nenarúšajú hydrolipidovú vrstvu epidermy.
Zloženie micelárnej kozmetiky
Ďalšou výhodou micel, ktoré sú veľmi malými časticami, je, že neexistujú žiadne obmedzenia týkajúce sa zloženia, v ktorom sa môžu používať. Môžu sa použiť v ich najobľúbenejšej forme – micelárnej vode – ale aj v krémoch a pleťových mliekach.
K dispozícii sú aj vysoko koncentrované gélové zloženia, ktoré nevyžadujú použitie uterákov ani vatových tampónov, ale stačí ich vmasírovať do pokožky a opláchnuť vodou.
Trojstupňový účinok micel
- Priťahovanie nečistôt vďaka hydrofóbnym zvyškom,
- Zapuzdrenie , ktoré zachytáva molekuly tuku a nečistôt vo vnútri micel,
- Odstránenie nečistôt zachytených v micelách prostredníctvom hydrofilných hláv, ktoré zostávajú v kontakte s vodnou fázou.
Ďalšie priemyselné aplikácie micel
- Kozmetológia , najmä micelárne tekutiny a odličovacie mlieka, ale aj micelárne šampóny na hĺbkové čistenie pokožky hlavy a sprchové gély.
- Farmaceutika , napríklad na zvýšenie biologickej dostupnosti účinných látok zavedením liekov s obmedzenou rozpustnosťou do tela vo forme neiónových micelárnych roztokov.
- Čistiace prostriedky – vyššie uvedený proces solubilizácie vysvetľuje fyzikálno-chemické procesy prania. Micelárne koloidy vo forme roztokov obklopujú tuk, oddeľujú nečistoty a odstraňujú ich z tkaniny. Pri použití iónových povrchovo aktívnych látok získajú častice nečistôt a povrch, na ktorý priľnú, rovnaký náboj, vďaka čomu sa dajú ľahko oddeliť.
- Fyzikálne a chemické procesy : micelárna katalýza, inhibícia chemických reakcií, flotácia a procesy získavania ropy.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf



























































































































