Micelas são aglomerados microscópicos de moléculas caracterizadas por uma estrutura esférica. São um grupo de compostos tensoativos, ou seja, surfactantes, muito eficazes e comumente utilizados. Graças às suas propriedades únicas, desempenham um papel muito importante em muitas indústrias, incluindo a cosmetologia.

Devido à sua estrutura, as micelas absorvem praticamente todos os tipos de impurezas da superfície onde são aplicadas. As micelas são mais frequentemente mencionadas no contexto de cosméticos de limpeza facial, mas também são ingredientes de produtos como detergentes para roupas e detergentes para louças. As soluções micelares são caracterizadas por sua capacidade de dissolver compostos pouco solúveis, que é a definição do processo de solubilização.
Estrutura e propriedades das micelas
A estrutura das micelas determina suas propriedades físico-químicas únicas. Nesta seção, veremos como as micelas são formadas, de que são compostas e quais processos determinam seu comportamento em soluções.
Pelos olhos de um químico
Micelas nada mais são do que colóides associativos formados como resultado do processo de micelização . Este processo refere-se à transformação de moléculas ou íons anfifílicos, que, como resultado da dissolução, sofrem autoassociação em aglomerados maiores.
As micelas não são, portanto, um grupo específico de compostos químicos, mas sim uma forma específica de organização de suas moléculas. Essa transformação espontânea, resultando na formação de micelas, é característica de várias substâncias orgânicas cujas moléculas são compostas por duas partes com polaridades significativamente diferentes.
Quando o conteúdo de surfactantes em uma solução aumenta, em uma determinada concentração de associados, essas estruturas características começam a se formar. O ponto de partida para tais transformações é chamado de concentração de CMC.
O que significa CMC?
CMC, ou concentração crítica de micelização , é a concentração na qual as micelas começam a se formar como resultado da autotransformação de monômeros acumulados em agregados maiores . Essa formação de aglomerados de moléculas também é acompanhada por uma mudança em suas propriedades físicas.
Acima da CMC, tal grupo de moléculas permanece em equilíbrio com moléculas individuais, tornando-se assim uma forma termodinamicamente estável. Esse equilíbrio é um ponto-chave de transição, pois pode prosseguir continuamente em ambas as direções. Por exemplo, durante a diluição, as micelas se decompõem novamente. Abaixo da concentração de CNC, as moléculas do surfactante se movem livremente na solução sem qualquer estrutura organizada.
Propriedades físicas das micelas
À medida que a concentração de surfactante na solução aumenta, ocorrem as seguintes alterações:
- Tensão superficial,
- Condutividade elétrica,
- Intensidade de dispersão de luz,
- Viscosidade.
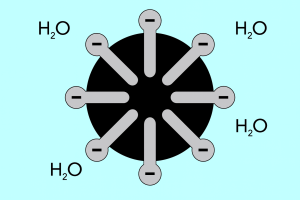
Cabeça e cauda – estrutura das micelas
A estrutura das micelas pode ser dividida em duas partes principais, que diferem significativamente na polaridade e são chamadas de:
- Cabeça hidrofílica , que possui alta afinidade pela água. É a parte da micela responsável pela tendência das partículas de se combinarem com a água, mas também por repelir gorduras.
- A cauda hidrofóbica , também conhecida como cauda lipofílica, tem o efeito oposto – atrai moléculas para as gorduras e repele a água.
A área hidrofóbica é mais frequentemente composta por cadeias de hidrocarbonetos, radicais:
- alquila,
- alquilaril,
- radicais de hidrocarbonetos fluorados.
A região hidrofílica consiste em grupos que interagem fortemente com a água, como os grupos ionogênicos. Grupos não iônicos, como os grupos éter, também podem fazer parte da região hidrofílica das micelas, mas isso geralmente requer a presença de um número maior de grupos polares na molécula.
O processo de micelização
Devido ao fato de que a parte apolar da substância, por exemplo, a cadeia alquílica de uma única molécula de surfactante dispersa, tem uma grande área de superfície em contato com a água, e a interação entre várias moléculas de água é muito mais forte do que sua interação com os grupos –CH2 presentes na cadeia, a entropia do sistema diminui e as moléculas de água começam a se organizar no local da cadeia alquílica.
Isso causa um tipo de deslocamento das cadeias de hidrocarbonetos do interior da fase aquosa. À medida que a concentração do surfactante aumenta, também aumenta o número de colisões entre elas. Isso também aumenta a probabilidade de agregação e espessamento das moléculas.
A condensação das moléculas é acompanhada por uma diminuição da entalpia livre. Este também é o resultado da combinação de resíduos apolares com um núcleo apolar em estado líquido, que é separado da fase aquosa por grupos polares.
Uma vez atingida a concentração de CMC mencionada acima, ou seja, a concentração micelar crítica, acumulam-se aglomerados esféricos, nos quais os grupos polares das partículas individuais são direcionados para a fase aquosa, enquanto as cadeias de hidrocarbonetos apolares formam o interior. As micelas formadas dessa forma são chamadas de micelas normais.
Em solventes orgânicos, podem ocorrer micelas reversas, nas quais a parte hidrofóbica está localizada na parte externa.

Tipos e exemplos de surfactantes
O tipo de surfactante usado para formar micelas tem um enorme impacto em sua estrutura e funcionalidade. Abaixo você encontrará os tipos e exemplos mais comuns de surfactantes que formam micelas
Exemplos de íons tensoativos
Íons e cátions com carga negativa:
- carboxilato,
- sulfato,
- sulfonato,
- fosfato.
Íons e cátions com carga positiva:
- amônio,
- fosfônio.
Tipos de surfactantes
- Surfactantes iônicos
- Aniônico, por exemplo SDS, ou dodecilsulfato de sódio,
- Catiônico, por exemplo CTAB, ou brometo de cetil trimetil amônio,
- Ânfions, ou seja, íons chamados anfifílicos ou bipolares, que têm um grupo catiônico carregado positivamente e um grupo aniônico carregado negativamente, por exemplo, Lecitina, ou seja, Fosfatidilolina.
- Surfactantes não iônicos, por exemplo, polioxietilenos.
Atividade de superfície de surfactantes e estrutura micelar
Este parâmetro, característico de compostos tensoativos, aumenta com o número de grupos metileno presentes na cadeia de hidrocarbonetos.
Devido à estrutura da cadeia, as micelas podem ser divididas em:
- Cadeia única
- Aniônico, por exemplo SDS,
- Catiônico, por exemplo CTAB.
- Corrente dupla
- Aniônico, por exemplo, AOT, ou seja, bis(2-etilhexil) succinatossulfonato de sódio,
- Catiônico, por exemplo, brometo de dihexadecildimetilamônio.
- Molecular, por exemplo, MGDG, ou seja, monogalactosil diglicerídeo.

Aplicação de micelas
As micelas têm uma ampla gama de aplicações, da cosmetologia à indústria farmacêutica e química. Conheça as áreas mais importantes onde suas propriedades são utilizadas na prática.
Limpeza de pele eficaz
Isso é possível graças à presença de partículas lipofílicas e hidrofílicas. Por exemplo, em demaquilantes que contêm água micelar, as partículas hidrofóbicas se ligam ao sebo e aos resíduos de maquiagem na pele, enquanto as partículas hidrofílicas atraem poeira e sujeira. Isso resulta em um efeito de limpeza duplo, permitindo uma limpeza eficaz e completa sem ressecamento ou irritação desnecessários.
Os produtos micelares são recomendados até mesmo para peles sensíveis devido à sua ação suave. Não há necessidade de esfregar ou pressionar com força com discos de algodão, e a ação desses coloides é comparável à de um ímã sobre a sujeira. Soluções aquosas com micelas não perturbam a camada hidrolipídica da epiderme.
Formulação de cosméticos micelares
Outra vantagem das micelas, que são partículas muito pequenas, é que não há restrições quanto às formulações em que podem ser utilizadas. Elas podem ser usadas em sua forma mais popular – água micelar – mas também em cremes e loções.
Fórmulas em gel altamente concentradas também estão disponíveis, que dispensam o uso de toalhas ou discos de algodão, bastando massageá-las na pele e enxaguar com água.
Ação de três estágios das micelas
- Atraindo impurezas graças às caudas hidrofóbicas,
- Encapsulamento , que retém moléculas de gordura e sujeira dentro das micelas,
- Remoção de impurezas presas em micelas através de cabeças hidrofílicas que permanecem em contato com a fase aquosa.
Outras aplicações industriais de micelas
- Cosmetologia , principalmente líquidos micelares e loções demaquilantes, mas também xampus micelares para limpeza profunda do couro cabeludo e géis de banho.
- Farmácia , por exemplo, para aumentar a biodisponibilidade de substâncias ativas introduzindo no organismo medicamentos com solubilidade limitada na forma de soluções micelares não iônicas.
- Produtos de limpeza – o processo de solubilização mencionado explica a físico-química da lavagem. Coloides micelares, na forma de soluções, envolvem a gordura, separam a sujeira e a removem do tecido. Quando surfactantes iônicos são usados, as partículas de sujeira e a superfície à qual aderem adquirem a mesma carga, facilitando a separação entre elas.
- Processos físicos e químicos : catálise micelar, inibição de reações químicas, processos de flotação e recuperação de óleo.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf



























































































































