Miceller är mikroskopiska kluster av molekyler som kännetecknas av en sfärisk struktur. De är en vanligt förekommande och mycket effektiv grupp av ytaktiva föreningar, dvs. tensider. Tack vare sina unika egenskaper spelar de en mycket viktig roll inom många industrier, inklusive kosmetika.

På grund av sin struktur absorberar miceller praktiskt taget alla typer av föroreningar från ytan de appliceras på. Miceller nämns oftast i samband med ansiktsrengöringskosmetika, men de är också ingredienser i produkter som tvättmedel och diskmedel. Micellära lösningar kännetecknas av sin förmåga att lösa upp svårlösliga föreningar, vilket är definitionen av solubiliseringsprocessen.
Struktur och egenskaper hos miceller
Micellernas struktur avgör deras unika fysikalisk-kemiska egenskaper. I det här avsnittet ska vi titta på hur miceller bildas, vad de är sammansatta av och vilka processer som avgör deras beteende i lösningar.
Genom en kemists ögon
Miceller är inget annat än associativa kolloider som bildas som ett resultat av micelliseringsprocessen . Denna process avser omvandlingen av amfifila molekyler eller joner, vilka, som ett resultat av upplösning, genomgår självassociation till större kluster.
Miceller är därför inte en specifik grupp av kemiska föreningar, utan snarare en specifik form av organisation av deras molekyler. Denna spontana omvandling som resulterar i bildandet av miceller är karakteristisk för olika organiska ämnen vars molekyler består av två delar med signifikant olika polariteter.
När innehållet av tensider i en lösning ökar, vid en viss koncentration av associerade föreningar, börjar dessa karakteristiska strukturer bildas. Utgångspunkten för sådana omvandlingar kallas CMC-koncentrationen.
Vad står CMC för?
CMC, eller kritisk micelliseringskoncentration , är den koncentration vid vilken miceller börjar bildas som ett resultat av självbildningen av ackumulerade monomerer till större aggregat . Denna bildning av kluster av molekyler åtföljs också av en förändring i deras fysikaliska egenskaper.
Ovanför CMC förblir en sådan grupp av molekyler i jämvikt med enskilda molekyler och blir därmed en termodynamiskt stabil form. Denna jämvikt är en viktig övergångspunkt, eftersom den kan fortskrida kontinuerligt i båda riktningarna. Till exempel, under utspädning bryts micellerna ner igen. Under CNC-koncentrationen rör sig de ytaktiva molekylerna fritt i lösningen utan någon organiserad struktur.
Micellernas fysikaliska egenskaper
När koncentrationen av ytaktivt ämne i lösningen ökar sker följande förändringar:
- Ytspänning,
- Elektrisk ledningsförmåga,
- Ljusspridningsintensitet,
- Viskositet.
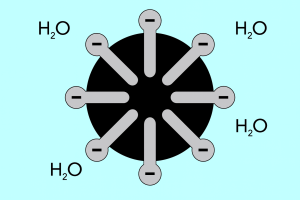
Huvud och svans – micellernas struktur
Micellernas struktur kan delas in i två huvuddelar, som skiljer sig avsevärt åt i polaritet och kallas:
- Hydrofilt huvud , som har hög affinitet för vatten. Det är den del av micellen som ansvarar för partiklarnas tendens att binda sig till vatten, men också att stöta bort fetter.
- Den hydrofoba svansen , även känd som den lipofila svansen, som har motsatt effekt – den attraherar molekyler till fetter och stöter bort vatten.
Det hydrofoba området är oftast kolvätekedjor, radikaler:
- alkyl,
- alkylaryl,
- fluorerade kolväteradikaler.
Det hydrofila området består av grupper som interagerar tillräckligt starkt med vatten, såsom jonogena grupper. Nonjoniska grupper, såsom etergrupper, kan också utgöra en del av det hydrofila området hos miceller, men detta kräver vanligtvis närvaron av ett större antal polära grupper i molekylen.
Micelliseringsprocessen
På grund av att den opolära delen av ämnet, till exempel alkylkedjan i en enda dispergerad tensidmolekyl, har en stor yta i kontakt med vatten, och interaktionen mellan flera vattenmolekyler är mycket starkare än deras interaktion med –CH2- grupperna som finns i kedjan, minskar systemets entropi och vattenmolekylerna börjar organisera sig vid alkylkedjans plats.
Detta orsakar en slags förskjutning av kolvätekedjor från det inre av vattenfasen. Allt eftersom koncentrationen av det ytaktiva ämnet ökar, ökar även antalet kollisioner mellan dem. Detta ökar också sannolikheten för aggregering och förtjockning av molekylerna.
Kondensationen av molekyler åtföljs av en minskning av fri entalpi. Detta är också resultatet av kombinationen av opolära rester med en opolär kärna i flytande tillstånd, som är separerad från vattenfasen av polära grupper.
När den ovannämnda CMC-koncentrationen, dvs. den kritiska micellkoncentrationen, uppnås, ackumuleras sfäriska kluster, där de polära grupperna i enskilda partiklar riktas mot vattenfasen, medan de opolära kolvätekedjorna bildar det inre. De miceller som bildas på detta sätt kallas normala miceller.
I organiska lösningsmedel kan omvända miceller förekomma, där den hydrofoba delen är belägen på utsidan.

Typer och exempel på tensider
Den typ av tensider som används för att bilda miceller har en enorm inverkan på deras struktur och funktionalitet. Nedan hittar du de vanligaste typerna och exemplen på tensider som bildar miceller
Exempel på ytaktiva joner
Negativt laddade joner, katjoner:
- karboxylat,
- sulfat,
- sulfonat,
- fosfat.
Positivt laddade joner, katjoner:
- ammonium,
- fosfonium.
Typer av tensider
- Joniska tensider
- Anjoniska, till exempel SDS, eller natriumdodecylsulfat,
- Katjonisk, till exempel CTAB, eller cetyltrimetylammoniumbromid,
- Amfioner, dvs joner som kallas amfifila eller bipolära, som har både en positivt laddad katjonisk grupp och en negativt laddad anjonisk grupp, t.ex. lecitin, dvs. fosfatidylolin.
- Nonjoniska tensider, till exempel polyoxietylener.
Ytaktivitet hos tensider och micellstruktur
Denna parameter, karakteristisk för ytaktiva föreningar, ökar med antalet metylengrupper som finns i kolvätekedjan.
På grund av kedjans struktur kan miceller delas in i:
- Enkelkedja
- Anjoniska, t.ex. SDS,
- Katjoniska, t.ex. CTAB.
- Dubbelkedjad
- Anjonisk, t.ex. AOT, dvs. natriumbis(2-etylhexyl)succinatsulfonat,
- Katjonisk, t.ex. dihexadecyldimetylammoniumbromid.
- Molekylär, t.ex. MGDG, dvs. monogalaktosyldiglycerid.

Applicering av miceller
Miceller har ett brett användningsområde, från kosmetika till läkemedel och kemisk industri. Lär dig mer om de viktigaste områdena där deras egenskaper används i praktiken.
Effektiv hudrengöring
Detta är möjligt tack vare närvaron av både lipofila och hydrofila partiklar. Till exempel, i sminkborttagningsmedel som innehåller micellärt vatten, binder hydrofoba partiklar till talg och sminkrester på huden, medan hydrofila partiklar attraherar damm och smuts. Detta resulterar i en dubbel rengöringseffekt, vilket möjliggör effektiv och grundlig rengöring utan onödig uttorkning eller irritation.
Micellära produkter rekommenderas till och med för känsliga hudtyper på grund av deras skonsamma verkan. Det finns inget behov av att skrubba eller trycka hårt med bomullsrondeller, och dessa kolloiders verkan jämförs med en magnets på smuts. Vattenlösningar med miceller stör inte epidermis hydrolipidskikt.
Formulering av micellär kosmetika
En annan fördel med miceller, som är mycket små partiklar, är att det inte finns några begränsningar för de formuleringar de kan användas i. De kan användas i sin mest populära form – micellärt vatten – men även i krämer och lotioner.
Mycket koncentrerade gelformler finns också tillgängliga, vilka inte kräver användning av handdukar eller bomullsrondeller, utan bara behöver masseras in i huden och sköljas av med vatten.
Trestegsverkan av miceller
- Attraherar orenheter tack vare hydrofoba svansar,
- Inkapsling , som fångar fett- och smutsmolekyler inuti micellerna,
- Avlägsnande av föroreningar som fångats i miceller genom hydrofila huvuden som förblir i kontakt med vattenfasen.
Andra industriella tillämpningar av miceller
- Kosmetologi , främst micellära vätskor och sminkborttagningslotioner, men även micellära schampon för djuprengöring av hårbotten och duschgeler.
- Apotek , till exempel för att öka biotillgängligheten av aktiva substanser genom att introducera läkemedel med begränsad löslighet i kroppen i form av nonjoniska micellära lösningar.
- Rengöringsprodukter – den tidigare nämnda solubiliseringsprocessen förklarar tvättens fysikaliskemi. Micellära kolloider i form av lösningar omger fett, separerar smuts och avlägsnar det från tyget. När joniska tensider används får smutspartiklarna och ytan de fäster på samma laddning, vilket gör dem lätta att separera från varandra.
- Fysikaliska och kemiska processer : micellär katalys, hämning av kemiska reaktioner, flotation och oljeåtervinningsprocesser.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf



























































































































