Micele to mikroskopijne skupiska cząsteczek, charakteryzujące się kulistą strukturą. Stanowią powszechnie stosowaną i bardzo skuteczną grupę związków powierzchniowo czynnych, czyli surfaktantów. Dzięki swoim wyjątkowym właściwością odgrywają bardzo ważną rolę w wielu dziedzinach przemysłu, w tym kosmetologii.

Ze względu na swoją budowę, micele praktycznie wchłaniają wszelkiego rodzaju zanieczyszczenia ze stosowanej powierzchni. Najczęściej o micelach mówi się w kontekście kosmetyków do oczyszczania twarzy, jednak są one składnikami również takich produktów jak detergenty do prania czy środki do mycia naczyń. Roztwory micelarne charakteryzują się zdolnością do rozpuszczania związków trudno rozpuszczalnych, co jest definicją procesu solubilizacji.
Budowa i właściwości miceli
Budowa miceli decyduje o ich unikalnych właściwościach fizykochemicznych. W tej części przyjrzymy się, jak powstają micele, z czego się składają i jakie procesy determinują ich zachowanie w roztworach.
Okiem chemika
Micele to nic innego, jak koloidy asocjacyjne powstałe w wyniku procesu micelizacji. Takim procesem nazywamy przemianę cząsteczek lub jonów o charakterze amifilowym, które w wyniku rozpuszczania poddają się samoasocjacji w większe skupiska.
Micele nie są więc konkretną grupą związków chemicznych, ale bardziej specyficzną formą organizacji ich cząsteczek. Taka samorzutna przemiana skutkująca wytwarzaniem miceli jest charakterystyczna dla różnych substancji organicznych, których cząsteczki zbudowane są ze znacznie różniących się od siebie polarnością dwóch części.
Gdy zawartość związków powierzchniowo czynnych w roztworze wzrasta, przy określonym stężeniu asocjatów zaczynają powstawać takie właśnie charakterystyczne struktury. Punkt rozpoczęcia takich przemian nazywa się stężeniem CMC.
Co oznacza skrót CMC?
CMC, czyli krytyczne stężenie powstawania miceli (ang. critical micellization concentration), to stężenie, przy którym rozpoczyna się powstawanie miceli wskutek samoasocjacji skumulowanych monomerów w większe agregaty. Takiemu tworzeniu się skupisk cząsteczek towarzyszy również zmiana ich właściwości fizycznych.
Powyżej CMC taki zespół cząsteczek pozostaje w stanie równowagi z pojedynczymi cząsteczkami, dzięki czemu staje się formą termodynamicznie trwałą. Ta równowaga jest kluczowym punktem przemiany, ponieważ może przebiegać ciągle w obydwu kierunkach. Na przykład podczas rozcieńczania micele ulegają ponownemu rozkładowi. Poniżej stężenia CNC cząsteczki związków powierzchniowo czynnych poruszają się swobodnie w roztworze, bez zorganizowanej struktury.
Właściwości fizyczne miceli
Wraz ze zwiększaniem się w roztworze stężenia substancji powierzchniowo czynnej, następuje zmiana:
- Napięcia powierzchniowego,
- Przewodnictwa elektrycznego,
- Intensywności rozpraszania światła,
- Lepkości.
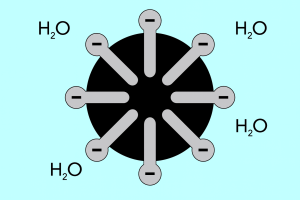
Głowa i ogon – budowa miceli
Strukturę miceli możemy podzielić na dwie główne części, które znacznie odbiegają od siebie polarnością i nazywane są:
- Hydrofilową głową, która posiada wysokie powinowactwo do wody. Stanowi część micelu, która odpowiedzialna jest za skłonność cząstek do łączenia się z wodą, ale i odpychania się od tłuszczy.
- Hydrofobowym ogonem, inaczej nazywanym lipofilowym, który działa przeciwnie – powoduje przyciąganie cząsteczek do tłuszczy oraz odpychanie się od wody.
Obszar hydrofobowy to najczęściej łańcuchy wodorowęglanowe, rodniki:
- alkilowy,
- alkiloarylowy,
- fluorowany węglowodorowy.
Obszar hydrofilowy stanowią grupy, które charakteryzują się dostatecznie silnym oddziaływaniem z wodą, na przykład grupy jonotwórcze. Również niejonowe grupy, takie jak eterowe, mogą stanowić część hydrofilową miceli, jednak zazwyczaj wymaga to obecności większej ilości polarnych grup w cząsteczce.
Proces micelizacji
Ze względu na to, że niepolarna reszta substancji, na przykład łańcuch alkilowy pojedynczej rozproszonej cząsteczki surfaktantu, ma dużą powierzchnię zetknięcia z wodą, a oddziaływanie pomiędzy kilkoma cząsteczkami wody jest znacznie silniejsze od ich oddziaływań z obecnymi w łańcuchu grupami –CH2, następuje zmniejszenie się entropii układu i rozpoczęcie uporządkowywania cząsteczek wody w miejscu łańcucha alkilowego.
Powoduje to swego rodzaju wypieranie łańcuchów węglowodorowych z wnętrza fazy wodnej. Wraz ze wzrostem stężenia związku powierzchniowo czynnego, zwiększa się również liczba zachodzących pomiędzy nimi zderzeń. Powoduje to również zwiększone prawdopodobieństwo agregacji oraz zagęszczania się cząsteczek.
Zagęszczaniu się cząsteczek towarzyszy z kolei zmniejszanie się entalpi swobodnej. Jest to również wynikiem łączenia się niepolarnych reszt z niepolarnym rdzeniem o ciekłym stanie skupienia, który jest oddzielany od fazy wodnej poprzez grupy o charakterze polarnym.
Po osiągnięciu wspomnianego wcześniej stężenia CMC, czyli krytycznego stężenia powstawania miceli, kumulują się kuliste skupiska, w których polarne grupy pojedynczych cząstek są skierowane ku fazie wodnej, natomiast niepolarne łańcuchy węglowodorowe tworzą wnętrze. Tak powstałe micele nazywa się normalnymi.
W rozpuszczalnikach organicznych mogą występować micele odwrotne, w których na zewnątrz znajduje się część hydrofobowa.

Typy i przykłady surfaktantów
Rodzaj surfaktantów użytych do tworzenia miceli ma ogromny wpływ na ich strukturę i funkcjonalność. Poniżej znajdziesz najczęściej występujące typy i przykłady związków powierzchniowo czynnych, które budują micele
Przykłady jonów powierzchniowo czynnych
Jony z ładunkiem ujemnym, kationy:
- karboksylowe,
- siarczanowe,
- sulfonianowe,
- fosforanowe.
Jony z ładunkiem dodatnim, kationy:
- amoniowe,
- fosfoniowe.
Typy surfaktantów
- Jonowe surfaktanty
- Anionowe, na przykład SDS, czyli Sodium dodecylsulfate,
- Kationowe, na przykład CTAB, czyli Cetyltrimethylammonium bromie,
- Amfijony, czyli jony nazywane obojnaczymi lub dwubiegunowymi, które posiadają zarówno dodatnio naładowaną grupę kationową, jak i ujemnie naładowaną grupę anionową, na przykład Lecithin, czyli Phosphatidyloline.
- Niejonowe surfaktanty, na przykład Polyoxyethylenes.
Aktywność powierzchniowa surfaktantów a budowa miceli
Ten parametr charakterystyczny dla związków powierzchniowo czynnych rośnie wraz ze wzrostem liczby grup metylenowych obecnych w łańcuchu wodorowęglanowym.
Ze względu na budowę łańcucha, micele możemy podzielić na:
- Jednołańcuchowe
- Anionowe, np. SDS,
- Kationowe, np. CTAB.
- Dwułańcuchowe
- Anionowe, np. AOT, czyli bis(2etyloheksylo)-bursztynianosulfonian sodowy,
- Kationowe, np. Bromek diheksadecylodimetylamoniony.
- Cząsteczkowe, np. MGDG, czyli monogalakto-syl-digliceryd.

Zastosowanie miceli
Micele mają szerokie zastosowanie – od kosmetologii po farmację i przemysł chemiczny. Poznaj najważniejsze obszary, w których ich właściwości są wykorzystywane w praktyce.
Efektywne oczyszczanie skóry
Jest możliwe dzięki obecności zarówno lipofilowych, jak i hydrofilowych cząstek. Przykładowo, w kosmetykach do demakijażu zawierających wodę micelarną, cząstki o charakterze hydrofobowym łączą się z obecnymi na skórze sebum oraz resztkami makijażu, a cząstki hydrofilowe przyciągają osiadające na niej kurz i zabrudzenia. Powoduje to dualizm oczyszczania, dzięki czemu możliwe jest skuteczne i dogłębne oczyszczenie bez zbędnego wysuszania i podrażniania.
Produkty micelarne są bowiem polecane nawet dla cer wrażliwych, dzięki swojemu delikatnemu działaniu. Nie jest przy nich konieczne szorowanie czy mocne dociskanie używanych wacików, a działanie tych koloidów porównuje się do magnezu na zabrudzenia. Roztwory wodne z micelami nie naruszają warstwy hydrolipidowej naskórka.
Formulacja kosmetyków micelarnych
Zaletą tak małych cząstek, jakimi są micele, jest również brak ograniczenia co do występujących z nimi formulacji. Możliwe jest ich wykorzystanie w najpopularniejszej formie – wody micelarnej, ale również w kremach czy balsamach.
Powstają również silnie skondensowane formuły żelowe, które nie wymagają używania ręczników czy płatków kosmetycznych, a jedynie wmasowania w skórę i spłukania wodą.
Trzyetapowe działanie miceli
- Przyciąganie zanieczyszczeń dzięki hydrofobowym ogonom,
- Enkapsulacja, która powoduje zamykanie we wnętrzu miceli cząsteczek tłuszczu i brudu,
- Usuwanie uwięzionych w micelach zanieczyszczeń poprzez pozostające w kontakcie z fazą wodną hydrofilowe głowy.
Inne zastosowania miceli w przemyśle
- Kosmetologia, głównie płyny micelarne i balsamy do demakijażu, ale również szampony micelarne do głębokiego oczyszczania skóry głowy, żele pod prysznic.
- Farmacja, na przykład w celu zwiększenia przyswajalności substancji czynnych poprzez wprowadzanie do organizmu leków wykazujących ograniczoną rozpuszczalność, w postaci niejonowych roztworów micelarnych.
- Środki czystości – wspomniany proces solubilizacji wyjaśnia fizykochemię prania. Koloidy micelarne w postaci roztworów powodują otaczanie tłuszczu, oddzielanie zabrudzeń i oddzielanie ich od tkaniny. Podczas stosowania surfaktantów jonowych cząstki zanieczyszczeń i powierzchnia, do której przylegają, uzyskują taki sam ładunek, dzięki czemu łatwo się od siebie oddzielają.
- Procesy fizyczne i chemiczne: katalizy micelarne, inhibitowanie reakcji chemicznych, flotacja oraz procesy odzysku ropy naftowej.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf


























































































































