Micely jsou mikroskopické shluky molekul charakterizované kulovitou strukturou. Jsou běžně používanou a velmi účinnou skupinou povrchově aktivních látek, tj. tenzidů. Díky svým jedinečným vlastnostem hrají velmi důležitou roli v mnoha odvětvích, včetně kosmetologie.

Vzhledem ke své struktuře micely absorbují prakticky všechny druhy nečistot z povrchu, na který jsou aplikovány. Micely se nejčastěji zmiňují v kontextu kosmetiky pro čištění obličeje, ale jsou také složkou produktů, jako jsou prací prostředky a myčky nádobí. Micelární roztoky se vyznačují schopností rozpouštět špatně rozpustné sloučeniny, což je definice procesu solubilizace.
Struktura a vlastnosti micel
Struktura micel určuje jejich jedinečné fyzikálně-chemické vlastnosti. V této části se podíváme na to, jak micely vznikají, z čeho se skládají a jaké procesy určují jejich chování v roztocích.
Očima chemika
Micely nejsou nic jiného než asociativní koloidy vzniklé v důsledku micelizace . Tento proces se týká transformace amfifilních molekul nebo iontů, které v důsledku rozpouštění podléhají samoasociaci do větších shluků.
Micely tedy nejsou specifickou skupinou chemických sloučenin, ale spíše specifickou formou organizace jejich molekul. Tato spontánní transformace vedoucí ke vzniku micel je charakteristická pro různé organické látky, jejichž molekuly se skládají ze dvou částí s výrazně odlišnou polaritou.
Když se obsah povrchově aktivních látek v roztoku zvýší, při určité koncentraci asociátů se tyto charakteristické struktury začnou tvořit. Výchozí bod pro takové transformace se nazývá koncentrace CMC.
Co znamená zkratka CMC?
CMC neboli kritická micelární koncentrace je koncentrace, při které se micely začínají tvořit v důsledku samovolné reakcí nahromaděných monomerů do větších agregátů . Tato tvorba shluků molekul je také doprovázena změnou jejich fyzikálních vlastností.
Nad CMC zůstává taková skupina molekul v rovnováze s jednotlivými molekulami, a stává se tak termodynamicky stabilní formou. Tato rovnováha je klíčovým bodem přechodu, protože může probíhat kontinuálně v obou směrech. Například během ředění se micely opět rozpadají. Pod koncentrací CNC se molekuly povrchově aktivní látky volně pohybují v roztoku bez jakékoli organizované struktury.
Fyzikální vlastnosti micel
S rostoucí koncentrací povrchově aktivní látky v roztoku dochází k následujícím změnám:
- povrchové napětí,
- Elektrická vodivost,
- Intenzita rozptylu světla,
- Viskozita.
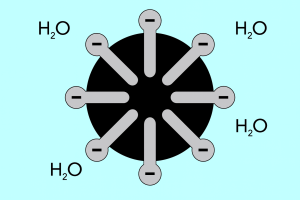
Hlava a ocas – struktura micel
Strukturu micel lze rozdělit na dvě hlavní části, které se výrazně liší polaritou a nazývají se:
- Hydrofilní hlava , která má vysokou afinitu k vodě. Je to část micely, která je zodpovědná za tendenci částic spojovat se s vodou, ale také za odpuzování tuků.
- Hydrofobní ocas , známý také jako lipofilní ocas, má opačný účinek – přitahuje molekuly tuků a odpuzuje vodu.
Hydrofobní oblast jsou nejčastěji uhlovodíkové řetězce, radikály:
- alkyl,
- alkylaryl,
- fluorované uhlovodíkové radikály.
Hydrofilní oblast se skládá ze skupin, které dostatečně silně interagují s vodou, jako jsou ionogenní skupiny. Neiontové skupiny, jako jsou etherové skupiny, mohou také tvořit součást hydrofilní oblasti micel, ale to obvykle vyžaduje přítomnost většího počtu polárních skupin v molekule.
Proces micelizace
Vzhledem k tomu, že nepolární část látky, například alkylový řetězec jedné dispergované molekuly povrchově aktivní látky, má ve styku s vodou velký povrch a interakce mezi několika molekulami vody je mnohem silnější než jejich interakce se skupinami –CH2 přítomnými v řetězci, entropie systému klesá a molekuly vody se začínají organizovat v místě alkylového řetězce.
To způsobuje jakési vytěsnění uhlovodíkových řetězců z vnitřku vodné fáze. S rostoucí koncentrací povrchově aktivní látky se zvyšuje i počet srážek mezi nimi. To také zvyšuje pravděpodobnost agregace a ztluštění molekul.
Kondenzace molekul je doprovázena poklesem volné entalpie. To je také důsledkem kombinace nepolárních zbytků s nepolárním jádrem v kapalném stavu, které je od vodné fáze odděleno polárními skupinami.
Jakmile je dosaženo výše zmíněné koncentrace CMC, tj. kritické koncentrace micel, hromadí se sférické shluky, ve kterých jsou polární skupiny jednotlivých částic směrovány do vodné fáze, zatímco nepolární uhlovodíkové řetězce tvoří vnitřek. Takto vzniklé micely se nazývají normální micely.
V organických rozpouštědlech se mohou vyskytovat reverzní micely, ve kterých se hydrofobní část nachází na vnější straně.

Typy a příklady povrchově aktivních látek
Typ povrchově aktivních látek používaných k tvorbě micel má obrovský vliv na jejich strukturu a funkčnost. Níže naleznete nejběžnější typy a příklady povrchově aktivních látek, které tvoří micely
Příklady povrchově aktivních iontů
Záporně nabité ionty, kationty:
- karboxylát,
- síran,
- sulfonát,
- fosfát.
Kladně nabité ionty, kationty:
- amonný,
- fosfonium.
Druhy povrchově aktivních látek
- Iontové povrchově aktivní látky
- Aniontové, například SDS nebo dodecylsulfát sodný,
- Kationtové, například CTAB nebo cetyltrimethylamoniumbromid,
- Amfiony, tj. ionty nazývané amfifilní nebo bipolární, které mají jak kladně nabitou kationtovou skupinu, tak i záporně nabitou aniontovou skupinu, např. lecitin, tj. fosfatidylolin.
- Neiontové povrchově aktivní látky, například polyoxyethyleny.
Povrchová aktivita povrchově aktivních látek a micelární struktura
Tento parametr, charakteristický pro povrchově aktivní sloučeniny, se zvyšuje s počtem methylenových skupin přítomných v uhlovodíkovém řetězci.
Vzhledem k struktuře řetězce lze micely rozdělit na:
- Jednořetězcový
- Aniontové, např. SDS,
- Kationtové, např. CTAB.
- Dvojitý řetěz
- Aniontové, např. AOT, tj. bis(2-ethylhexyl)sukcinátsulfonát sodný,
- Kationtové, např. dihexadecyldimethylamoniumbromid.
- Molekulární, např. MGDG, tj. monogalaktosyldiglycerid.

Aplikace micel
Micely mají širokou škálu uplatnění, od kosmetologie přes farmaceutický a chemický průmysl. Seznamte se s nejdůležitějšími oblastmi, kde se jejich vlastnosti využívají v praxi.
Účinné čištění pleti
To je možné díky přítomnosti lipofilních i hydrofilních částic. Například v odličovačích obsahujících micelární vodu se hydrofobní částice vážou na kožní maz a zbytky make-upu, zatímco hydrofilní částice přitahují prach a nečistoty. Výsledkem je dvojí čisticí účinek, který umožňuje účinné a důkladné čištění bez zbytečného vysušování nebo podráždění.
Micelární produkty se díky svému šetrnému působení doporučují i pro citlivou pleť. Není třeba drhnout ani silně tlačit vatovými tampony a působení těchto koloidů se přirovnává k působení magnetu na nečistoty. Vodné roztoky s micelami nenarušují hydrolipidní vrstvu epidermis.
Složení micelární kosmetiky
Další výhodou micel, což jsou velmi malé částice, je, že neexistují žádná omezení ohledně složení, ve kterém se dají použít. Mohou být použity v jejich nejoblíbenější formě – micelární vodě – ale také v krémech a pleťových mlékách.
K dispozici jsou také vysoce koncentrované gelové přípravky, které nevyžadují použití ručníků ani vatových tamponů, ale stačí je vmasírovat do pokožky a opláchnout vodou.
Třístupňový účinek micel
- Přitahování nečistot díky hydrofobním ocasům,
- Zapouzdření , které zachycuje molekuly tuku a nečistot uvnitř micel,
- Odstranění nečistot zachycených v micelách pomocí hydrofilních hlavic, které zůstávají v kontaktu s vodnou fází.
Další průmyslové aplikace micel
- Kosmetika , zejména micelární tekutiny a odličovací mléka, ale také micelární šampony pro hloubkové čištění pokožky hlavy a sprchové gely.
- Farmacie , například ke zvýšení biologické dostupnosti účinných látek zavedením léčiv s omezenou rozpustností do těla ve formě neiontových micelárních roztoků.
- Čisticí prostředky – výše zmíněný proces solubilizace vysvětluje fyzikálně-chemické principy praní. Micelární koloidy ve formě roztoků obklopují tuk, oddělují nečistoty a odstraňují je z tkaniny. Při použití iontových povrchově aktivních látek získají částice nečistot a povrch, ke kterému přilnou, stejný náboj, díky čemuž se od sebe snadno oddělují.
- Fyzikální a chemické procesy : micelární katalýza, inhibice chemických reakcí, flotační a ropné procesy.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf






























































































































