Es handelt sich um mikroskopisch kleine Molekülcluster mit einer kugelförmigen Struktur. Sie bilden eine weit verbreitete und sehr wirksame Gruppe von oberflächenaktiven Verbindungen, den sogenannten Tensiden. Dank ihrer einzigartigen Eigenschaften spielen sie in vielen Industriebereichen, darunter auch in der Kosmetik, eine sehr wichtige Rolle.

Aufgrund ihres Aufbaus absorbieren Mizellen praktisch alle Arten von Verunreinigungen von der behandelten Oberfläche. Am häufigsten werden Mizellen im Zusammenhang mit Gesichtsreinigungsprodukten erwähnt, sie sind jedoch auch Bestandteile von Produkten wie Waschmitteln oder Geschirrspülmitteln. Mizelläre Lösungen zeichnen sich durch ihre Fähigkeit aus, schwer lösliche Verbindungen aufzulösen, was die Definition des Solubilisierungsprozesses ist.
Aufbau und Eigenschaften von Mizellen
Der Aufbau von Mizellen bestimmt ihre einzigartigen physikalisch-chemischen Eigenschaften. In diesem Abschnitt werden wir uns ansehen, wie Mizellen entstehen, woraus sie bestehen und welche Prozesse ihr Verhalten in Lösungen bestimmen.
Aus der Sicht eines Chemikers
Mizellen sind nichts anderes als assoziative Kolloide, die durch den Prozess der Mizellierung entstehen. Als solchen Prozess bezeichnen wir die Umwandlung von amphiphilen Molekülen oder Ionen, die sich durch Auflösung zu größeren Clustern selbst assoziieren.
Mizellen sind also keine bestimmte Gruppe chemischer Verbindungen, sondern eher eine spezifische Form der Organisation ihrer Moleküle. Eine solche spontane Umwandlung, die zur Bildung von Mizellen führt, ist charakteristisch für verschiedene organische Substanzen, deren Moleküle aus zwei Teilen bestehen, die sich in ihrer Polarität deutlich voneinander unterscheiden.
Wenn der Gehalt an Tensiden in der Lösung steigt, beginnen sich bei einer bestimmten Konzentration der Assoziate solche charakteristischen Strukturen zu bilden. Der Beginnpunkt solcher Umwandlungen wird als CMC-Konzentration bezeichnet.
Was bedeutet die Abkürzung CMC?
CMC, d. h. die kritische Mizellbildungskonzentration (engl. critical micellization concentration), ist die Konzentration, bei der die Mizellbildung infolge der Selbstassoziation ( ) der akkumulierten Monomere zu größeren Aggregaten beginnt. Diese Bildung von Molekülclustern geht auch mit einer Veränderung ihrer physikalischen Eigenschaften einher.
Oberhalb der CMC bleibt ein solcher Molekülkomplex im Gleichgewicht mit einzelnen Molekülen und wird so zu einer thermodynamisch stabilen Form. Dieses Gleichgewicht ist der entscheidende Punkt der Umwandlung, da es kontinuierlich in beide Richtungen verlaufen kann. Beispielsweise zerfallen die Mizellen bei Verdünnung wieder. Unterhalb der CNC-Konzentration bewegen sich die Moleküle der oberflächenaktiven Verbindungen frei in der Lösung, ohne eine organisierte Struktur zu bilden.
Physikalische Eigenschaften von Mizellen
Mit steigender Konzentration der oberflächenaktiven Substanz in der Lösung kommt es zu einer Veränderung:
- Oberflächenspannung,
- der elektrischen Leitfähigkeit,
- Lichtstreuungsintensität,
- Viskosität
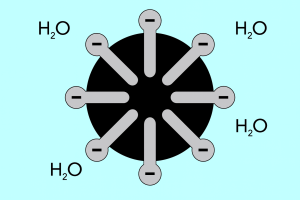
Kopf und Schwanz – Aufbau von Mizellen
Die Struktur der Mizellen lässt sich in zwei Hauptteile unterteilen, die sich in ihrer Polarität deutlich voneinander unterscheiden und wie folgt bezeichnet werden:
- Hydrophiler Kopf, der eine hohe Affinität zu Wasser aufweist. Er ist der Teil des Mizells, der dafür verantwortlich ist, dass sich die Partikel mit Wasser verbinden, aber von Fetten abgestoßen werden.
- Hydrophober Schwanz, auch lipophil genannt, der das Gegenteil bewirkt – er zieht die Moleküle zu Fetten hin und stößt sie von Wasser ab.
Der hydrophobe Bereich besteht meist aus Hydrogencarbonatketten, Radikalen:
- Alkyl-,
- Alkylarylradikale,
- fluorierte Kohlenwasserstoffradikale.
Der hydrophile Bereich besteht aus Gruppen, die sich durch eine ausreichend starke Wechselwirkung mit Wasser auszeichnen, beispielsweise ionogene Gruppen. Auch nichtionogene Gruppen wie Ethergruppen können Teil des hydrophilen Bereichs der Mizellen sein, jedoch erfordert dies in der Regel das Vorhandensein einer größeren Anzahl polarer Gruppen im Molekül.
Der Mizellierungsprozess
Da der unpolare Rest der Substanz, beispielsweise die Alkylkette eines einzelnen dispergierten Tensidmoleküls, eine große Kontaktfläche mit Wasser hat und die Wechselwirkung zwischen mehreren Wassermolekülen wesentlich stärker ist als ihre Wechselwirkung mit den in der Kette vorhandenen –CH(2) vorhandenen Gruppenin der Kette wesentlich stärker ist, kommt es zu einer Verringerung der Entropie des Systems und zu einer Anordnung der Wassermoleküle an der Stelle der Alkylkette.
Dies führt zu einer Art Verdrängung der Kohlenwasserstoffketten aus dem Inneren der Wasserphase. Mit steigender Konzentration der oberflächenaktiven Verbindung nimmt auch die Anzahl der zwischen ihnen stattfindenden Kollisionen zu. Dies führt auch zu einer erhöhten Wahrscheinlichkeit der Aggregation und Verdichtung der Moleküle.
Die Verdichtung der Moleküle geht wiederum mit einer Verringerung der freien Enthalpie einher. Dies ist auch das Ergebnis der Verbindung unpolarer Reste mit einem unpolaren Kern in flüssigem Zustand, der durch polare Gruppen von der Wasserphase getrennt wird.
Nach Erreichen der oben genannten CMC-Konzentration, d. h. der kritischen Konzentration für die Bildung von Mizellen, sammeln sich kugelförmige Aggregate an, in denen die polaren Gruppen der einzelnen Partikel zur Wasserphase hin ausgerichtet sind, während die unpolaren Kohlenwasserstoffketten das Innere bilden. Die so entstandenen Mizellen werden als normale Mizellen bezeichnet.
In organischen Lösungsmitteln können inverse Mizellen vorkommen, bei denen sich der hydrophobe Teil außen befindet.

Arten und Beispiele von Tensiden
Die Art der zur Bildung von Mizellen verwendeten Tenside hat einen großen Einfluss auf deren Struktur und Funktionalität. Nachfolgend finden Sie die häufigsten Arten und Beispiele von oberflächenaktiven Verbindungen, die Mizellen bilden
Beispiele für oberflächenaktive Ionen
Negativ geladene Ionen, Kationen:
- Carboxyl-,
- Sulfat-,
- Sulfonat-,
- Phosphat.
Positiv geladene Ionen, Kationen:
- Ammonium,
- Phosphonium.
Arten von Tensiden
- Ionische Tenside
- Anionische, zum Beispiel SDS, also Natriumdodecylsulfat,
- Kationische, zum Beispiel CTAB, also Cetyltrimethylammoniumbromid,
- Amphionische Tenside, d. h. Ionen, die als amphoter oder bipolär bezeichnet werden und sowohl eine positiv geladene kationische Gruppe als auch eine negativ geladene anionische Gruppe aufweisen, z. B. Lecithin, d. h. Phosphatidyloline.
- Nichtionische Tenside, zum Beispiel Polyoxyethylene.
Oberflächenaktivität von Tensiden und Aufbau von Mizellen
Dieser für oberflächenaktive Verbindungen charakteristische Parameter steigt mit zunehmender Anzahl der in der Hydrogencarbonat-Kette vorhandenen Methylengruppen.
Aufgrund der Struktur der Kette können Mizellen unterteilt werden in:
- Einkettige
- Anionische, z. B. SDS,
- Kationische, z. B. CTAB.
- Zweikettige
- Anionisch, z. B. AOT, d. h. Natrium-Bis(2-ethylhexyl)-succinatsulfonat,
- Kationisch, z. B. Dihexadecyldimethylammoniumbromid.
- Molekulare, z. B. MGDG, d. h. Monogalactosyl-Diglycerid.

Anwendung von Mizellen
Mizellen finden breite Anwendung – von der Kosmetik über die Pharmazie bis hin zur chemischen Industrie. Lernen Sie die wichtigsten Bereiche kennen, in denen ihre Eigenschaften in der Praxis genutzt werden.
Effektive Hautreinigung
Dies ist dank der Anwesenheit sowohl lipophiler als auch hydrophiler Partikel möglich. In Make-up-Entfernern, die Mizellenwasser enthalten, verbinden sich beispielsweise hydrophobe Partikel mit dem auf der Haut vorhandenen Talg und Make-up-Rückständen, während hydrophile Partikel Staub und Schmutz anziehen. Dies führt zu einer doppelten Reinigungswirkung, wodurch eine effektive und gründliche Reinigung ohne unnötige Austrocknung und Reizung möglich ist.
Mizellare Produkte werden aufgrund ihrer sanften Wirkung sogar für empfindliche Haut empfohlen. Es ist nicht notwendig, zu schrubben oder die verwendeten Wattepads fest aufzudrücken, und die Wirkung dieser Kolloide wird mit der von Magneten auf Schmutz verglichen. Wässrige Lösungen mit Mizellen beeinträchtigen die Hydrolipidschicht der Epidermis nicht.
Die Formulierung von Mizellenkosmetika
Ein weiterer Vorteil der winzigen Mizellenpartikel ist, dass sie in beliebigen Formulierungen verwendet werden können. Sie können in ihrer beliebtesten Form – als Mizellenwasser – aber auch in Cremes oder Lotionen verwendet werden.
Es werden auch stark konzentrierte Gelformulierungen hergestellt, die keine Handtücher oder Wattepads erfordern, sondern nur in die Haut einmassiert und mit Wasser abgespült werden müssen.
Dreistufige Wirkung von Mizellen
- Anziehung von Verunreinigungen durch hydrophobe Schwänze,
- Einkapselung, wodurch Fett- und Schmutzpartikel im Inneren der Mizellen eingeschlossen werden,
- Entfernung der in den Mizellen eingeschlossenen Verunreinigungen durch die hydrophilen Köpfe, die mit der Wasserphase in Kontakt bleiben.
Weitere Anwendungen von Mizellen in der Industrie
- Kosmetik, vor allem Mizellenflüssigkeiten und Make-up-Entferner, aber auch Mizellenshampoos zur Tiefenreinigung der Kopfhaut und Duschgels.
- Pharmazie, beispielsweise zur Erhöhung der Bioverfügbarkeit von Wirkstoffen durch die Einführung von Arzneimitteln mit begrenzter Löslichkeit in Form von nichtionischen Mizellenlösungen in den Körper.
- Reinigungsmittel – der erwähnte Solubilisierungsprozess erklärt die Physikochemie des Waschens. Mizellare Kolloide in Form von Lösungen umhüllen Fett, lösen Schmutzpartikel und trennen sie vom Gewebe. Bei der Verwendung von ionischen Tensiden erhalten die Schmutzpartikel und die Oberfläche, an der sie haften, die gleiche Ladung, wodurch sie sich leicht voneinander trennen lassen.
- Physikalische und chemische Prozesse: Mizellenkatalyse, Hemmung chemischer Reaktionen, Flotation und Prozesse zur Rückgewinnung von Erdöl.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf


























































































































